時間:

翻譯:華溶應用中心
審核:工業藥劑發燒友
Amp B是兩性霉素B的脂質體制劑,這是一種復雜的胃腸外抗真菌藥物,迄今為止尚未獲得美國食品及藥物管理局批準的仿制藥版本。對于通用Amp B脂質體產品開發,藥物釋放曲線的檢查對于產品質量控制和與列出的參比藥物的分析可比性評估非常重要。然而,目前尚無Amp B脂質體的標準化體外藥物釋放(IVR)試驗。在本研究中,我們描述了基于USP-4流池法溶出儀的IVR試驗的開發,該試驗能夠根據藥物釋放譜鑒別Amp B脂質體注射劑。IVR試驗開發的目標是確定釋放介質組成和試驗溫度,能夠在24h內促進Amp B脂質體70-100%的藥物釋放,而不會出現Amp B沉淀或脂質體結構破壞。我們發現,在5%蔗糖、10% mM HEPES和0.01% NaN3(pH為7.4)的釋放介質中添加5% w/v β -環糊精可防止Amp B沉淀并促進藥物釋放。IVR分析溫度的增加導致藥物釋放速率的增加,故選擇55°C作為在不引起樣品沉淀的情況下促使藥物釋放達到溶出平臺的最高溫度。所開發的IVR試驗用于區分Amp B脂質體和Amp B膠束產品(如Fungizone?和Fungcosome)的藥物釋放速率。IVR試驗還能夠區分與AmBisome?成分相同但通過擠出或均質工藝制備的Amp B脂質體,這兩種工藝均導致可測量的脂質體粒度異質性和Amp B濃度差異。最后,使用USP-4 IVR分析比較了Amp B與印度批準的兩種仿制藥Amphonex?(Bharat Serum and Vaccines Ltd.)(f2為66.3)和Phosome?(Cipla Ltd.)(f2為55.4)之間的Amp B釋放曲線。總之,所開發的USP-4 IVR測定法可作為仿制藥Amp B脂質體制劑開發中藥物釋放圖譜表征的有用工具。
兩性霉素B脂質體注射劑
體外藥物釋放試驗
USP-4流池法溶出儀
仿制藥產品特性
AmBisome@是兩性霉素B的脂質體制劑,于1997年首次進入美國市場。目前,它是許多侵襲性真菌感染和內臟利什曼病或血液惡性腫瘤患者接受化療和器官或同種異體骨髓移植時最廣泛使用的治療方法。AmBisome@的年銷售量超過3.5億,2016年美國專利到期,是仿制藥的主要目標。然而,對于所有復雜注射給藥制劑,開發Amp B脂質體注射劑仿制藥一直具有挑戰性。難點在于,對于AmBisome@等藥物而言,不僅是產品成分,工藝制造步驟也會顯著影響產品的整體功效和安全性。由于Amp B在水溶液中的溶解性差,并且需要在脂質體雙層中與二硬脂酷磷脂酷甘油(DSPG)進行AmpB絡合,因此AmBisome@生產工藝相當精細。為確保Amp B脂質體的穩定性,為該產品選擇的脂質混合物必須具有高相變溫度,因為許多生產步驟必須在高達65°C的溫度下進行。此外,AmBisome@的平均脂質體粒度相當小(小于100nm),多分散性低,需要高度控制粒度減小,以實現自制制劑和參比制劑之間的特性匹配
此外,產品的許多理化特性決定了AmpB在體內的釋放速率,這與動物和人類的毒性直接相關。這些產品質量特性包括薄膜中Amp B的物理狀態、脂質體粒度均勻性、脂質體相變溫度和未包封藥物的量。為確保實現所需的產品特性,幾個Amp B脂質體生產步驟至關重要。這些工藝參數包括:有機相中脂質體組分濃度、有機相組成、組分混合順序、均質條件和產品凍干參數。
雖然已有幾個AmpB脂質體仿制藥在美國境外獲得批準,但由于產品安全問題,許多產品相繼撤出市場。其中兩種產品是最初在阿根廷獲批的Anfgen@ (GenpharmaS.A.)和最初在印度獲批的Lambin@ (Sun Pharmaceutical Industries) 。當將Anfgen@和Lambin@與AmBisome@進行比較時,基于LD-50值,這兩種仿制藥對小鼠的毒性是前者的2-10倍,并且在肺曲霉病小鼠模型中顯示出較低的療效。這兩種仿制產品的處方組成與AmBisome?完全相同,仿制產品的功效和安全性的差異歸因于AmpB的快速釋放。因此,開發能夠區分Amp B脂質體制劑的體外藥物釋放方法至關重要
最近,一些基于體外釋放的IVR檢測方法已用于表征多種特殊制劑如混懸液、聚合物微球和脂質體的釋放特性, 與傳統的“透析袋”和“樣品和分離”的方法相比,這些VR分析具有一些顯著的優勢,包括使用標準USP-4溶出度儀、針對不同釋放條件易于調節參數、無需采樣的自動藥物檢測以及無外部干擾的閉環系統。可通過升高溫度和在釋放介質中添加增溶劑的情況下對復雜注射給藥制劑進行USP-4溶出試驗,以促進活性藥物成分(AP)從高度穩定的脂質體、微球或混懸制劑中釋放。所有這些優勢將極大地有助于建立一種穩定且可重復的AmpB脂質體制劑的IVR檢測方法。
我們在這里介紹了使用USP-4溶出儀進行AmpBIVR分析的開發,該溶出儀能夠區分AmpB脂質體和其產品的相似處方,這些產品的組成與AmBisome@相同,但表現出不同的AmpB釋放速率。將幾種增溶劑添加到釋放介質中,并篩選它們在不立即破壞脂質體結構的情況下提高AmpB溶解度和釋放速率的能力。調節釋放介質中的IVR分析條件(如溫度、藥物濃度和增溶劑濃度),以確保AmBisome@24h內釋放超過70%的Amp B。IVR試驗用于評估AmBisome@與兩種仿制藥Amphonex@ (Bharat Serumand Vaccines Ltd.)和Phosome@ (Cilpa Ltd)之間Amp B釋放速率的相似性,這兩種仿制藥目前在印度銷售。 其他基于膠束的制劑,如Fungizone@ (X-GenPharmaceuticals,FDA批準)和Fungcoome (上海新亞藥業,中國批準),使用我們的方法表現出明顯不同的釋放速率。此外,在已建立的USP-4IVR試驗中,使用與AmBisome@生產工藝不同的方法在內部制備的AmpB脂質體制劑(導致粒度分布略有不同)也表現出與AmBisome@相比不同的釋放速率。我們還評估了USP-4IVR是否能夠通過檢查AmBisome@樣品強制降解釋放的藥物來提供穩定性信息。 總之,建立的USP-4IVR測定可用于質量控制,以指導仿制藥Amp B脂質體制劑的開發和仿制藥的分析可比性測試。
2.1、 材料
AmBisome?(安斯泰來制藥股份有限公司)和Fungizone?(X-Gen制藥公司)從密歇根大學醫院藥房購買,兩性霉素B(Amp B)、γ-環糊精(γ-CD)、羥丙基環糊精(HP - CD)和Fungcosome購自SHJNJ Pharmatech(中國上海), Amp B參比標準品購自USP(Rockville,MD),Amphonex?和Phoso ?由Bharat Serum and Vaccines Ltd. (印度孟買)提供。DSPG和HSPC購自Lipoid (Newark, NJ),膽固醇購自AvantiPolar脂類公司(Alabaster,Alabama),Floor-A-Lyzer ?透析管的分子量截止值為300kDa,購自美國加利福尼亞州蘭喬多明格斯光譜實驗室。蔗糖購自Fluka,十二烷基硫酸鈉(SDS)、異丙醇、HEPES、α -生育酚、NaN3和所有其他試劑均購自西格瑪。為確保定量分析的準確性,本研究中使用的所有緩沖液均在使用前制備。
2.2、方法
2.2.1. Amp B脂質體的制備
脂質體 (35:20-8; 35:41-4; 35:48-7)基于NeXstar的公開專利,并進行了一些修改。 首先,將33.6mg DSPG、85.2mg HSPC、20.8mg膽固醇和0.256mgα-生育酚加入含14.0μL水(2% v/v)的1mL乙醇中,加熱至65°C,并攪拌溶解脂質。 將溶于0.3 mL DMSO中的20mg Amp B預熱至65°C,并添加到脂質溶液中。將2.6 mL的70°C預加熱緩沖液(10mM琥珀酸鈉,10%(w/v)蔗糖,pH 4.8)加入Amp B/脂質溶液中,在70°C下間歇攪拌15分鐘,并冷卻至室溫。在4°C下用緩沖液(10 mM琥珀酸鈉,10%(w/v)蔗糖,pH 4.8)透析混懸液,并進行兩次凍融循環。Amp B的目標濃度為0.7 mg/mL,以避免過濾時堵塞膜孔。將混懸液使用200nm聚碳酸酯膜過濾一次和80nm聚碳酸酯膜過濾七次,以獲得最終的Amp B脂質體處方35:20-8。
將252 mg DSPG和150 mg Amp B加入7.5 mL MeOH/DMSO(7/2,v/v)中,加熱至65°C,并加入150 μL H2O(2%,v/v)和124 μL 2.5M HCl,制備處方35:41-4。 將混合物在65°C下加熱攪拌,直至所有組分溶解,并觀察到透明橙色的DSPG/Amp B溶液。將639 mg HSPC、156 mg膽固醇和1.92 mg α-生育酚等其他脂質體組分在7.5 mL MeOH/DMSO(7/2,v/v)中,在65℃下溶解5min。將兩種制備的溶液混合,并在65°C下再放置10min,然后加入73μL 2.5M NaOH。 在恒溫65°C的夾套攪拌容器中,將脂質溶液加入到135 mL預加熱緩沖液(10mL琥珀酸鈉,10%蔗糖(w/v),pH 4.8)中,迅速攪拌15min后,冷卻后,用十倍體積的緩沖液(10mM琥珀酸鹽,10%蔗糖(w/v),pH5.5)置換,并通過切向流過濾濃縮至4mg/mL Amp B。 使用M-110P型微流化器(馬薩諸塞州韋斯特伍德微流化公司)對脂質體混懸液進行均質處理,在10000 psi下處理七次,形成35:48-7,在20000 psi下處理四次,形成35:41-4。
2.2.2.Amp B脂質體粒度分析
測量前,添加0.9 mL釋放介質或去離子水稀釋0.1 mL Amp B脂質體,通過使用Malvern Instruments ZetaSizer 3000HSa(馬薩諸塞州韋斯特伯勒)動態光散射測定室溫下的平均粒徑和多分散性。對于Amp B膠束制劑,在不稀釋的情況下分析樣品。所有樣品重復分析三次。
2.2.3.高效液相色譜法分析Amp B濃度
采用配備UV檢測器的高效液相色譜 (HPLC) 測量不同制劑中的Amp B濃度。 使用Higgins PROTO 300 C18柱(250×4.6 mm,5μm,Higgins Analytical Inc.,Mountain View, California)在室溫下進行色譜分離。 流動相由 (A) 含0.1% v/v三氟乙酸的甲醇和 (B) 含0.1% v/v三氟乙酸的水組成,濃度梯度為60-84% A,運行時間9分鐘,流速為1mL/min,檢測波長為390 nm。將Amp B參比標準品溶于二甲基亞砜中,形成貯備液(4mg/mL),用甲醇稀釋至80μg/mL,對于所有Amp B制劑,將100 μL樣品溶于1mL DMSO中,然后用甲醇稀釋至5mL。在高效液相色譜分析之前,所有樣品在12000轉/分的轉速下離心10min,并根據峰面積使用外標法計算不同制劑中的Amp B濃度。
2.2.4.基于單瓶樣品IVR分析AmBisome?釋放條件篩選
對于釋放介質組成的選擇,將AmBisome?置于浸沒在38.4 mL釋放介質中的Float-A-Lyzer?(分子量截止值300 kDa)錐形離心管中,在單瓶的IVR分析中進行釋放實驗。簡言之,用1.5 mL釋放介質稀釋0.1 mL AmBisome?或游離Amp B(4mg/mL)貯備液,然后置于Float-alyzer ?中(釋放介質中的最終Amp B濃度為10μg/mL),將溶液在45°C下保溫24h,并在180 rpm下振搖。所有考察實驗的釋放介質均由5%蔗糖、10mM HEPES和0.01% NaN3(pH為7.4)組成。考察了添加5% γ-CD、5% HP-CD、0.25% SDS或10% IPA對Amp B釋放速率的影響,取0.1mL 4mg/mL的游離Amp B貯備液直接加入39.9 mL釋放介質中作為對照品(10μg/mL)。以預定時間間隔取出溶出介質等分試樣(300 μL),并用新鮮釋放介質代替。 使用Synergy Neo HTS多模式微孔板讀數器(BioTek儀器公司,VT,美國),通過414 nm的紫外吸光度測定不同時間釋放的Amp B量。
為了考察單瓶IVR試驗中釋放條件對Amp B釋放性能的影響,在45 ℃、55 ℃和60 ℃的溫度下進行了釋放研究。為了考察增溶劑濃度對Amp B釋放的影響,測試了γ- CD1、2.5、5和10% (w/v) 的濃度。在總釋放介質中,采用不同的Amp B初始濃度5μg/mL、10μg/mL和30μg/mL進行IVR分析,其他釋放條件和實驗步驟與上文所述相同。
如前所述,使用DLS分析比較了AmBisome?釋放前后的平均粒徑和PDI。在釋放介質中稀釋樣品,并通過三個獨立實驗獲得平均粒徑。
2.2.5.建立用于區分AmBisome?和其他Amp B 處方制劑的USP-4 IVR檢測方法
使用USP-4溶出儀(推薦使用華溶DS-7CP流池法溶出系統)檢查了AmBisome?或其他Amp B處方制劑的Amp B釋放情況。簡言之,將含有樣品的1.6 mLAmBisome?或其他Amp B處方制劑置于Float-A-Lyzer ?中(試管中的Amp B濃度等于0.5 mg/mL),然后插入USP-4流通池中,每個池體添加78.4 mL釋放介質(Amp B的最終濃度為10μg/mL),將溶媒以16mL/min的閉環管路填充,并保持在55°C,通過紫外線吸收檢測Amp B每小時的釋放量。在方法開發階段,將等量游離Amp B溶液(10μg/mL)直接與釋放介質混合作為對照,以模擬Amp B從制劑中完全釋放,并用紫外吸光光度法檢測Amp B在釋放期間的變化。 通過將每個時間點釋放的AmBisome?或其他Amp B處方制劑釋放的Amp B量除以Amp B對照溶液的釋放量,計算累積釋放量(%)。所有實驗中的釋放量均一式三份,結果報告為平均值±SEM。
通過此方法測試的Amp B處方制劑包括:(A) Micelle Amp B處方(Fungizone?, X-Gen Pharmaceuticals, Inc.美國);(b) Fungcosome,由中國上海新亞藥業有限公司生產的混合膠束制劑;(C)具有與AmBisome?相同成分的通用Amp B脂質體制劑,如Amphonex?(巴拉特血清和疫苗有限公司)和Phosome?(Cilpa有限公司);(d)Amp B脂質體制劑,其組成與通過均質(35:41-4和35:48-7)或擠出(35:20-8)制備的AmBisome?相同。
使用以下公式進行f2測試,以比較AmBisome?和其他Amp B處方制劑的累積釋放是否存在顯著差異。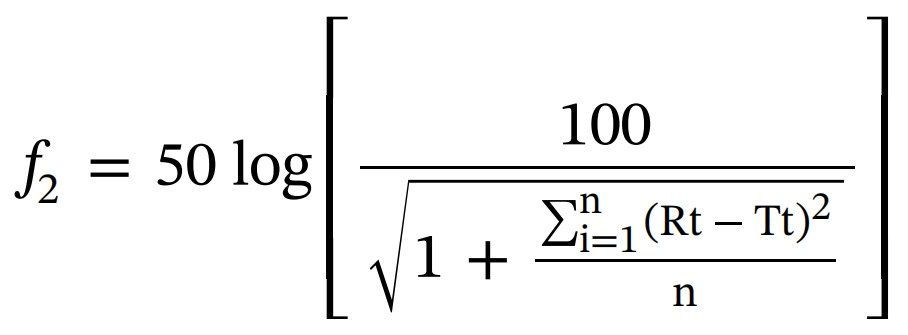
變量如下:n是時間點的數量,Rt是參比產品在時間點t (t>0) 的累積釋放值,Tt是測試批次在同一時間點的累積釋放值。 所有時間點的累積釋放值(n=24)用于計算f2。 相似因子f2≥50的試驗制劑被認為與參比制劑相似。如果 f2值為100,表明測試曲線和參比曲線相同,并且隨著值變小,釋放曲線之間的差異會增加。
2.2.6.驗證USP-4流池法溶出儀IVR測定是否具備穩定性
瓶裝AmBisome?根據生產說明進行水合處理,冷藏儲存最長達七個月。 采用USP-4 IVR法對老水化樣品和新水化樣品進行分析,并計算f2值。此外,將水合AmBisome?等分試樣在60°C下保溫七小時、三天和七天。對強制降解樣品和非強制降解樣品進行了體外循環試驗,并計算了f2值。
3.1.增溶劑對單瓶AmBisome?釋放的影響
由于Amp B的水溶性較差,必須向釋放介質中添加增溶劑,以確保下沉條件。 此外,通常在復合注射給藥制劑的釋放介質中增溶劑,以促進活性藥物成分 (API) 的釋放。 例如,在USP-4 IVR試驗中,使用羥丙基環糊精溶解多柔比星并促進其從Doxil?中釋放,同時添加乙腈和乙醇以促進依維莫司和左炔諾孕酮聚合物微球制劑的藥物釋放。為了快速篩選多種增溶劑,在45°C和振搖的條件下,在單瓶AmBisome?釋放試驗中進行了IVR分析。 為確保增溶劑的添加不會導致脂質體破壞,在放行研究結束時測量了AmBisome?的粒度。 當使用5% HP - CD或10% IPA作為增溶劑時,在釋放介質中觀察到Amp B沉淀(圖1 a, b)。 由于Amp B沉淀,Amp B在釋放介質(線C)中的總吸光度顯著低于Amp B在添加0.25% SDS(圖1c)或5% γ-CD(圖1d)的介質中的總吸光度。 添加0.25%SDS可更快地釋放AmBisome?(A線),但AmBisome?(A線)的粒度從119nm減小到23nm(表1),表明表面活性劑破壞了脂質體結構。 此外,從Float-A-Lyzer ?中釋放的游離Amp B在含有0.25%SDS的介質中緩慢且達不到平臺(B線),表明Amp B可能溶解在緩慢透過300 kDa膜的SDS膠束中。當將0.5% (w/v) SDS添加到地塞米松脂質體的釋放介質中時,Bhardwaj等人觀察到脂質體的類似結構破壞以及脂質體含量的立即釋放。與SDS不同的是,在釋放介質中加入5%的γ-CD,使游離Amp B溶液從Float-A-Lyzer ?中快速完全釋放(圖1d)。添加5%的γ-CD僅導致AmBisome?粒度微小增加,并允許24.2%的藥物在45°C下24h內釋放(圖1d)。在5% γ-CD溶媒中進行IVR分析發現AmBisome?平均粒徑從118nm增加至123nm,表明脂質體在藥物釋放試驗期間保持完整(見表1)。基于該數據,選擇γ-CD作為Amp B增溶劑,并進行了額外的IVR分析優化研究,以提高脂質體的藥物釋放速率。
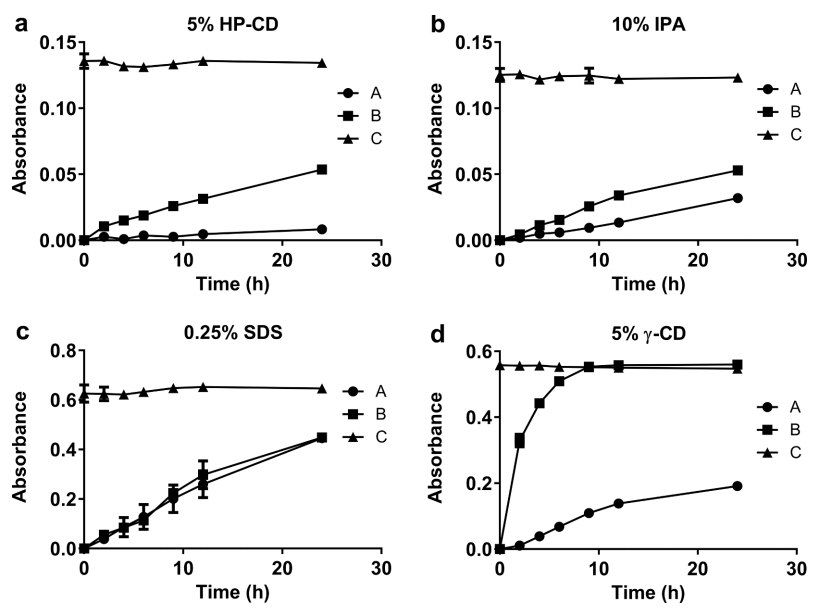
圖1. 在45°C條件下,單瓶裝AmBisome?試驗中,增溶劑添加到釋放介質中對Amp B釋放的影響,包括5% HP-CD(a)、10% IPA(b)、0.25% SDS(c)或5% γ-CD(d)。曲線代表:A.AmBisome?在 Float-A-Lyzer? (●)中;b. Float-A-Lyzer?中的游離Amp B溶液 (■);C.釋放介質中的游離Amp B (▲)。對于所有組,釋放介質中的最終Amp B濃度為10μg/mL。
表1.不同釋放條件對AmBisome?穩定性的影響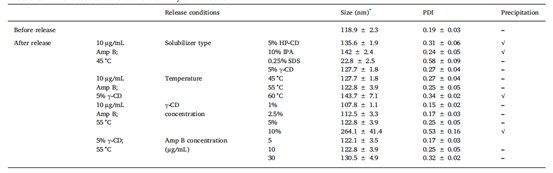
在釋放研究完成之前和之后,使用釋放介質稀釋后,通過DLS測量粒徑。
3.2.通過IVR測定溫度、γ-CD濃度和Amp B濃度對單瓶AmBisome?釋放的影響
本研究的總體目標是建立一種可在8-24小時內釋放70-100%藥物的IVR試驗。時間要求來自對IVR分析方法的實際需求,該方法將在分析實驗室進行批量分析。從脂質體制劑中釋放70-100%的原料藥,確保了IVR分析的鑒別能力,完全釋放后,更有可能確定不同制劑之間的藥物釋放速率,進一步優化測定條件,以提高單瓶IVR測定的Amp B釋放的完整性。通過差示掃描量熱法測定,AmBisome?在56°C時相變溫度較高,因為脂質體由完全飽和的磷脂和膽固醇組成。為了提高復合脂質體或聚合物微球產品的藥物釋放速率,IVR分析通常在接近或高于產品相變溫度下進行。例如,Doxil?和Risperdal? Consta? USP-4釋放試驗均在45°C下進行。因此,為了提高Amp B的釋放速率,在含有5% γ- CD的釋放介質中,在45 ℃、55 ℃和60 ℃下進行IVR分析。如圖2a所示,溫度升高對AmBisome?的Amp B釋放有顯著影響,在45°C、55°C和60°C下分別有35%、76%和98%的累積藥物釋放。IVR分析溫度的升高對Float-A-Lyzer ?中游離Amp B溶液的擴散速率沒有影響(圖2b)。當分析溫度高達60°C時,AmBisome?的粒度適度增加,并觀察到產品沉淀(見表1),表明AmBisome?在這種高溫下不穩定。因此,選擇55°C IVR分析溫度進行后續研究。

圖2. 在不同釋放溫度下,通過單瓶的IVR分析,從Float-A-Lyzer ?中釋放AmBisome?(a)和游離Amp B(b)。添加5% γ-CD到溶媒中,所有實驗的總Amp B濃度為10μg/mL。
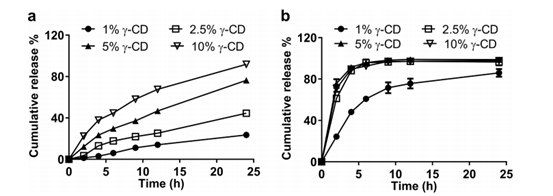
圖3. 在55°C下,通過單瓶的IVR分析,在不同γ - CD濃度下從Float-A-Lyzer ?中釋放AmBisome?(a)和游離Amp B(b)。所有實驗的總Amp B濃度均為10μg/mL。
為了研究釋放介質中γ-CD濃度對脂質體累積Amp B釋放的影響,我們在釋放介質中添加1%、2.5%、5%或10% γ-CD (w/v) 進行了研究(圖3),所有實驗均在55°C下進行。添加1% γ-CD后,從Float - A-Lyzer ?中釋放游離Amp B溶液的速度緩慢且不完全,表明藥物在1% γ-CD中的溶解度有限(圖3b)。對于其他 γ-CD濃度,Float-A-Lyzer ?中游離Amp B溶液的釋放迅速且完全。 我們觀察到隨著 γ-CD濃度的增加,AmBisome?的藥物釋放速率逐漸增加(圖3a)。這可能是由于Amp B通過 γ- CD與脂質體表面膽固醇結合而增加了溶解度。膽固醇的去除可有效提高脂質體的流動性,降低有效相變溫度,從而加快Amp B的釋放,降低脂質體的穩定性。在建立基于USP-4的Doxil? IVR分析之前,我們已經觀察到這種效應,在釋放介質中添加10% γ-CD時,這種現象最為明顯,24h釋放后AmBisome?粒度從118.9nm顯著增加到264.1nm(表1),表明脂質體可能聚集。由于釋放研究期間AmBisome?粒度顯著增加,后續研究中未使用10% γ-CD。在最終IVR試驗中,選擇了5%(w/v)γ-CD作為溶媒組分,以確保在試驗期間藥物釋放相對完整,而不會出現脂質體聚集。
通過調整Float-A-Lyzer?中脂質體的體積,研究了Amp B濃度對AmBisome?累積釋放的影響。為了在5μg/mL、10μg/mL和30μg/mL的釋放介質中達到最終的理論Amp B濃度(假設藥物釋放率為100%),將0.05、0.1和0.3 mL的AmBisome?(4mg Amp B/mL)添加到Float-A-Lyzer?中,并使用80mL的釋放介質。在所有濃度下僅觀察到24小時釋放的藥物量存在微小差異(圖4a),因此,所有后續研究均使用10μg/mL Amp B濃度,因為它為釋放藥物的紫外線檢測提供了足夠的靈敏度,并為進行IVR分析提供了最低要求的Amp B脂質體量。
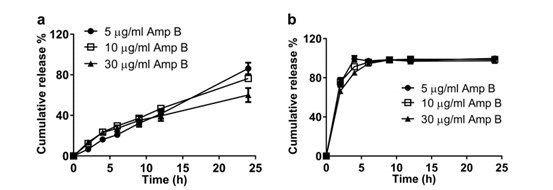
圖4.在55℃,5% γ-CD的條件下,通過單瓶IVR檢測不同Amp B濃度下Float-A-Lyzer?中AmBisome?(a)和游離Amp B (b)的釋放。
3.3.基于USP-4流池法溶出儀AmBisome?體外分析方法的優化
根據實驗結果,在USP-4流池法溶出儀的基礎上對單瓶IVR分析中的優化釋放條件進行了調整。在閉環中于55°C下進行IVR分析,溶媒以16mL/min的速度循環。最終釋放溶媒由5%蔗糖、10% mM HEPES、0.01% NaN3(pH為7.4)和5% γ-CD組成。將0.2 mLAmBisome?(4 mg/mL)與1.4 mL釋放介質混合,將脂質體或膠束置于最終濃度為0.5 mg/mL的Float-A-Lyzer?中,最后,在USP-4溶杯中加入78.4 mL溶媒,使釋放介質中的最終Amp B濃度達到10μg/mL(假定藥物釋放率為100%)。
在USP-4 IVR試驗裝置中,AmBisome?中Amp B的釋放與基于單瓶的IVR試驗相似,24h內約有75%的藥物釋放(圖5)。雖然選定的IVR條件為我們提供了區分Amp B各種脂質制劑的機會,但該檢測存在一些明顯的局限性。該測定在高于正常生理條件和5%γ-CD受體存在下進行,因此,IVR測得的釋放速率可能與Amp B體內釋放速率不同。此外,已知AmBisome?在體內給藥后與內源性血漿脂蛋白相互作用,并被人體網狀內皮系統吸收。需要指出的是,釋放藥物經過透析膜后測得的Amp B濃度可能與Float-alyzer?內脂質體釋放的Amp B濃度不同,因為透析膜是藥物的擴散屏障。Amp B從脂質體中的實際釋放速率可以使用將Float-A-Lyzer?外部的實測藥物濃度與薄膜內部的實際藥物濃度關聯起來的數學模型進行說明,正如Modi等人所做的那樣。
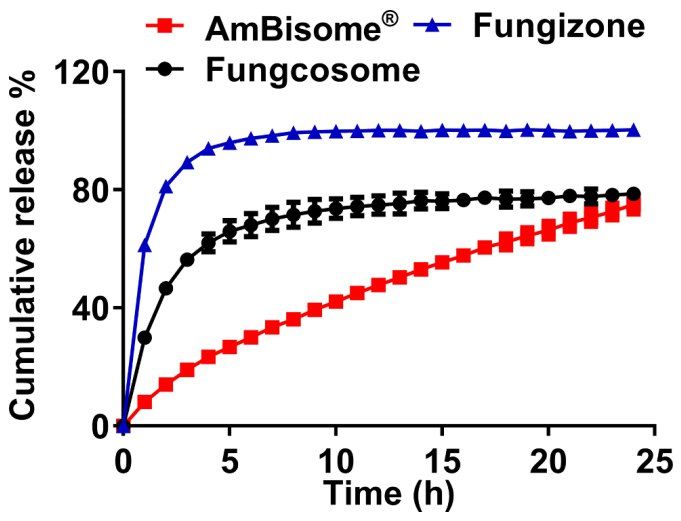
圖5. 在55°C下,不同商業Amp B制劑在Sotax?上的累積釋放。在溶媒中加入5% γ-CD,根據報告的包裝說明書藥物濃度,所有實驗的Amp B總濃度為10μg/mL。
為了消除IVR測量AmBisome?中的Amp B緩慢釋放的可能性,主要是由于釋放的Amp B與脂質體表面結合,在空白脂質體存在的情況下測量了Float-A-Lyzer?中游離Amp B的釋放。AmBisome?制劑中使用的相同比例的HSPC、DPPG和膽固醇來制備空白脂質體。空白脂質體和游離Amp B分別以與AmBisome?成分相同的比例(模擬100%的藥物釋放方案-高濃度)和低10倍的Amp B量(模擬10%的藥物釋放方案-低濃度)混合(補充圖1)。在低藥物濃度下,不存在或存在空白脂質體時均未觀察到Amp B釋放差異。在高藥物濃度下,在空白脂質體存在的情況下,Amp B釋放稍慢(延遲≤1小時),但仍比AmBisome?的藥物釋放更快。總之,釋放的Amp B與脂質體表面的結合對IVR測試性能的影響非常有限。在https://doi.org/10.1016/j.ejpb.2018.11.010的在線版本中,可以找到與本文相關的補充數據。
3.4通過USP-4 IVR測定比較AmBisome?和市售膠束Amp B制劑
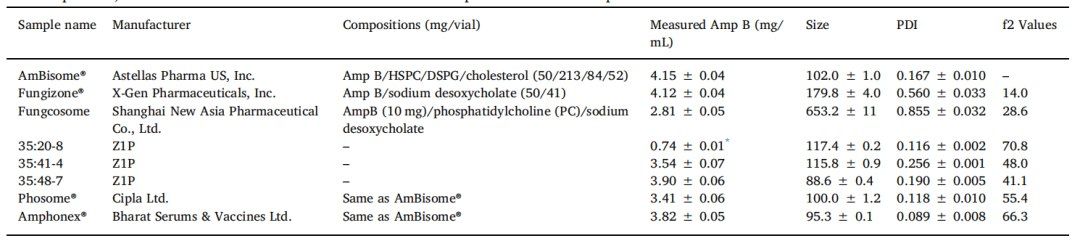
對適用于USP-4流池法溶出儀的IVR試驗進行了區分脂質體和膠束Amp B產品的能力測試。將脂質體AmBisome?的藥物釋放與其他兩種Amp B上市產品的藥物釋放進行了比較:由X-Gen Pharmaceuticals生產并在美國上市的膠束制劑Fungzione?,以及由上海新亞藥業有限公司在中國上市生產的膠束和脂質體混合物Fungcosome。表2根據這些產品的包裝說明書總結了本手稿中使用的所有Amp B產品的成分。Fungizone?是一種由脫氧膽酸鈉和Amp B組成的膠束,在最初的6小時內表現出極快的藥物釋放,累積藥物釋放接近100%(圖5)。Fungcosome囊體具有不同的組成,含有Amp B、脫氧膽酸鈉和磷脂酰膽堿的混合物,平均粒徑為653nm,相對Fungizone?囊體(180納米)和AmBisome?(102納米)大得多(表2)。盡管制劑不同,但在USP-4 IVR分析中,Fungcosome和Fungizone?的藥物釋放曲線相似,其特征是在6小時內快速釋放達到穩定。該釋放曲線表明,與脂質體相比,Fungcosome微粒體更像混合膠束制劑。有趣的是,Fungcosome的Amp B釋放量未達到100%,這可能是由于用于USP-4試驗的Amp B濃度4mg/mL(10mg/瓶,用2.5 mL 去離子水溶解)與我們使用高效液相色譜法測量的實際濃度2.8mg/mL之間存在差異。總之,這些結果表明USP-4方法能夠將AmBisome?與其他非Amp B脂質體制劑區分開來。
表2. 與AmBisome?相比,不同Amp B制劑的組成、特性和釋放f2值
該處方在較低的目標Amp B濃度下制備,以輔助擠出工藝。 在USP-4 IVR分析中,根據總釋放介質中Amp B的目標濃度10μg/mL進行稀釋。
3.5 Amp B脂質體制備方法對USP-4 IVR藥物釋放的影響
對于復雜的仿制產品,不僅成分,生產工藝也決定藥物釋放。通過均質化或擠出工藝制備了三種不同的Amp B脂質體制劑,以探討USP-4 IVR試驗是否能夠區分它們的藥物釋放特性。所有脂質體制劑均使用相同的藥物與脂類重量比為Amp B:HSPC:DSPG:膽固醇=50:213:84:52制備。將這些組分溶于酸化的甲醇-氯仿(50:50) 中,依次混合,通過旋轉蒸發干燥成粉末。用乳糖緩沖液對粉末進行水合并在65°C下攪拌,并將所得混懸液擠出或均質以減小脂質體粒度。使用Lipex擠出機在65°C下進行擠出,得到粒徑分布窄、平均粒度為117.4 nm、PDI為0.116(表2)的Amp B脂質體(35:20-8)。為避免擠壓濾芯堵塞,在低于AmBisome?4.0 mg/mL濃度的條件下,使用稀釋的Amp B脂質混懸液(0.75 mg/mL)進行擠壓。因此,測量樣品35:20-8中的最終Amp B濃度為0.74 mg/mL,并再次稀釋該制劑以進行藥物釋放和粒度分析。另外兩種制劑在65°C、20000psi(35:41-4)或10000psi(35:48-7)下使用Microfluidics 110-PS均質器均質。當使用低壓均質化時,需要通過M-110P微流化器七次,以達到目標脂質體粒度,平均粒徑為88.6 nm,PDI為0.190(35:48-7)。當脂質體在高壓下均質化時,需要四次才能達到目標粒徑,并且脂質體會再次具有不均勻的粒徑分布,平均粒徑為113.7 nm,PDI為0.26 (35:41-4) 。
脂質體粒度分布的差異導致USP-4 Amp B釋放量有差異。通過均質(35:48-7)制備的具有最小粒徑的非均質脂質體表現出最快的釋放速率,而通過擠出制備的具有較大粒徑的均質脂質體表現出較慢的Amp B釋放速率(35:20-8)(圖6)。與AmBisome?相比,我們制備的所有制劑均能更快地釋放Amp B,但計算出的用于評估釋放曲線相似性的f2值顯示,擠出脂質體35:20-8與AmBisome?之間具有高度相似性,f2值為70.8。相反,通過均質化制備的Amp B脂質體的f2值低于50,被認為與AmBisome?不同。除了生產工藝影響的脂質體粒徑大小差異外,不能排除處方組分最終比例存在潛在差異的可能性。與Amp B濃度不同,未在最終產品中測量脂質組分濃度,這在某種程度上限制了我們對藥物釋放結果的解釋。然而,這些數據表明,USP-4 IVR檢測對區分不同工藝制備的脂質體制劑中Amp B的釋放非常敏感。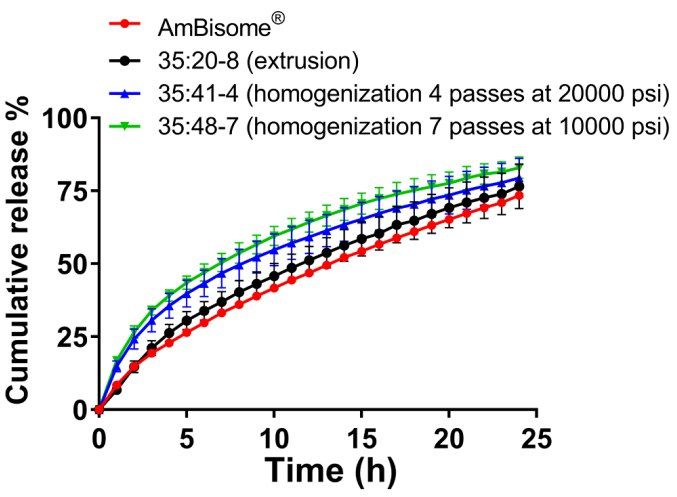
圖6. 不同Amp B脂質體制劑的累積釋放量在55°C下在Sotax?上由Z1P擠出和均質化制備而成。在介質中加入5% γ-CD,所有實驗的Amp B總濃度為10μg/mL。
3.6.通過USP-4 IVR測定AmBisome?的強制降解對Amp B釋放的影響
為了評估我們的AmBisome?含量測定是否獲得穩定性信息,將水合AmBisome?樣品冷藏儲存七個月,并通過含量測定進行檢驗。與儲存的產品相比,藥物釋放略快,但f2計算值為63.4,差異無統計學意義(圖7a)。此外,水合AmBisome?樣品在60°C下經受了八小時、三天和七天的強制降解,將強制降解的AmBisome?樣品中的Amp B釋放與實驗前水合脂質體中的藥物釋放進行比較,結果顯示,強制降解三天和七天的樣品釋放藥物的速度更快,計算的f2值分別為55.5和39.5(圖7a),然而,強制降解八小時的藥物釋放與非強制降解產品的釋放相似,f2值為94.5,表明AmBisome?產品具有較高的穩定性。綜上所述,我們的IVR分析似乎是穩定性指示性的,盡管輕度強制降解的AmBisome?樣品與非強制降解的AmBisome?樣品相比沒有統計學顯著差異,因為f2值通常超過50。缺乏統計學顯著性可能是由于AmBisome?的高穩定性以及已建立的AmBisome?無法檢測到產品的微小差異。
圖7. 實驗前水合AmBisome?、水合AmBisome?并儲存在2-8°C下七個月(a)和水合AmBisome?并儲存在60°C下八小時、三天和七天(b)的累積藥物釋放。 在55°C的條件下使用Sotax?進行IVR測試。在介質中加入5% γ-CD,所有實驗的總Amp B濃度為10μg/mL。
此外,為了檢測IVR分析從破壞的脂質體中區分藥物釋放的能力,我們在AmBisome?樣品中添加了10%SDS,從而將渾濁的脂質體樣品轉化為粒徑小于等于100nm的脂質-SDS- Amp B膠束澄清溶液(補充圖2)。隨后將AmBisome?與100:0、90:10、80:20、50:50和0:100比例的SDS裂解脂質體混合,破壞的脂質體和50:50混合物釋放藥物的速度非常快,但80:20、90:10混合物釋放Amp B的速度僅略快于完整的AmBisome?。缺乏差異可能是由于脂質-SDS-Amp B膠束的形成,其也表現出Amp B的緩慢釋放。總之,強制降解研究和SDS加成研究的結果突出了開發的IVR測定方法在區分能力上的一些缺點,以及開發脂質體產品的鑒別IVR測定的總體困難。
3.7.通過USP-4 IVR分析比較AmBisome?與在印度批準的仿制藥
為了進一步檢驗USP-4 IVR試驗的實用性,我們比較了AmBisome?和印度批準的仿制藥Amp B脂質體制劑釋放情況。雖然目前尚無FDA批準的仿制藥Amp B脂質體制劑,但全球已批準多種仿制藥。幾年前,印度批準了AmBisome?的仿制藥,其中一些仿制藥的成分相同,另一些仿制藥的成分略有不同。2016年,印度監管機構開會討論了與批準的Amp B脂質體制劑相關的安全性問題,并針對健康受試者的額外14天毒理學和單次低劑量藥代動力學評估提出了建議。 據我們所知,這一新的人體藥代動力學可比性要求僅適用于由Bharat Serum and Vaccines Ltd.生產的Amphonex?和由Cipla Ltd.生產的Phosome?。因此,這兩種產品仍可在印度市場上銷售,本研究已采購這兩種產品。根據包裝說明書,Amphonex?和Phosome?的成分均與AmBisome?相同。我們分析了所有產品的粒徑分布和藥物濃度,觀察到這兩種產品的平均粒度和PDI分別為100.0/0.118(Phosome?)和95.3/0.089(Amphonex?),均接近AmBisome?(102.0/0.167)(表2)。水合脂質體溶液中的Amp B濃度分別為3.41 mg/mL和3.82 mg/mL,兩種產品的標簽濃度均與AmBisome?相同,為4mg/mL。雖然Amp B脂質體制劑之間存在一些可測量的差異,但由于可用性有限,每種產品僅分析一個小瓶或一個批次。使用USP-4 IVR分析從AmBisome?、Phosome?和Amphonex?中釋放Amp B,表明這些產品之間存在相似性,兩種仿制藥均與AmBisome?相似,f2值大于50,但是,與AmBisome?相比,兩種仿制藥的藥物釋放都略慢(見圖8)。計算得出的f2值顯示,Amphonex?與AmBisome?之間的相似度(f2=66.3)略高于Phosome?與AmBisome?之間的相似度(f2=55.4)。重要的是,這些數值的統計能力有限,因為每個產品僅分析一個批次,了解批次間差異對于評估仿制藥與創新藥的相似性至關重要。此外,要證明USP-4 IVR檢測能夠區分AmBisome?和由印度監管機構從市場上撤出的仿制藥Amp B脂質體制劑(如Anfgen?(Genpharma)或Lambin?(Sun Pharmaceutical Industries)),這將具有巨大價值。 然而,我們未能獲得這些樣品,僅表明IVR分析可區分通過高壓均質法制備的AmBisome?和速釋Amp B脂質體。總之,USP-4 IVR分析是評估AmBisome?與仿制藥Amp B的相似性和差異性的有用工具。
圖8. Sotax?上不同仿制產品在55℃下的累積釋放,溶媒中加入5% γ-CD,所有實驗的總Amp B濃度均為10μg/mL。
雖然已建立的IVR測定法可以作為Amp B脂質體制劑的質量控制測試的有用工具,但該試驗不能模擬體內藥物釋放,此外,我們不能聲稱IVR試驗中更快速的藥物釋放與體內更快速的藥物釋放和產品更高的毒性相關,尚未確定IVR中產品性能與體內藥物釋放之間的體外-體內相關性(IVIVC)。這在設計在體外具有不同藥物釋放速率的Q1/Q2Amp B相同脂質體制劑或獲得具有略微不同藥物釋放特性的商業制劑將非常有用。通過驗證這些制劑的藥代動力學并將體內性能與體外藥物釋放相關,可以建立IVIVC。我們將嘗試在后續研究中建立IVIVC,等待速釋和緩釋制劑的采購,并從這些制劑中獲得可靠的藥代動力學數據。
建立了用于評價Amp B脂質體制劑的USP-4溶出儀IVR試驗。IVR檢測條件(溫度55°C,釋放介質中γ-CD受體濃度為5% w/v)與生理條件相差較遠,在不破壞脂質體結構的前提下,優化了IVR檢測條件以促進24 h內的藥物釋放,加速了藥物釋放,放大了制劑間Amp B初始釋放差異。該IVR試驗成功地用于區分AmBisome?脂質體和含有脫氧膽酸鈉的Amp B膠束制劑(如Fungizone?和Fungcosome)。IVR分析能夠區分內部使用不同方法制備的AmBisome?和Amp B脂質體制劑。對兩種不同的Amp B脂質體和AmBisome?的藥物釋放曲線之間的相對一致性進行了評估,但在對這些印度仿制藥的質量做出結論之前,需要對其他批次進行分析。總之,我們開發了USP-4 IVR測定法,可用于仿制藥行業快速檢測AmBisome?和類似Amp B脂質體制劑的藥物釋放情況。此外,IVR檢測開發過程中應用的原理可供其他人應用,以便為其他復雜產品(如脂質體、納米顆粒、微球、凝膠或混懸液)建立基于USP-4的IVR檢測。